概要
日本では国民の2人に1人が「がん」になり、さらに3人に1人が「がん」で亡くなる時代です。私たちの研究室では、血液がんの分子発症機序の解明を通じてがんの病態解明と創薬を目指しています。がん患者検体を次世代シーケンス(NGS)技術を用いた網羅的遺伝子解析を行い、臨床所見と併せた膨大なデータを基にがん病態機序の仮説を立て、マウスモデルを作製し検証します。さらに作製したモデルを試験管レベルに落とし込むことで、治療薬候補スクリーニング系を構築し、ケミカルバイオロジーを駆使した創薬開発を行っています。がんを「細胞レベル」からだけでなく、「個体レベル」で捉えた研究を基本に、「がん患者を治す」を目標に、ベッドサイドからベンチへ、ベンチからベッドサイドへのトランスレーショナル研究を実践しています。
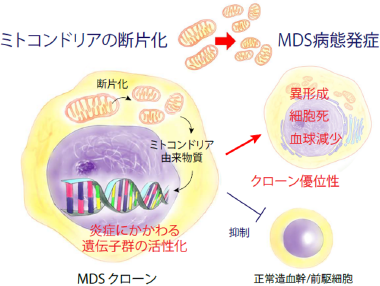
1. 骨髄異形成症候群の分子発症機序の解明
骨髄異形成症候群(Myelodysplastic syndromes, MDS)は 60 歳以上に好発する血液がんのひとつで、高齢化社会で増加している難治性の血液がんです。MDS発症の責任遺伝子として RUNX1変異を発見し、RUNX1変異による発症機序の解明を行っています(Blood 2003, Blood 2004, J Rad Res 2008, Blood 2008, Blood 2009, Blood 2010, Blood 2013)。最近、私たちは世界に先駆けミトコンドリアの過剰な断片化がMDSの主病態を引き起こすことを明らかにしました(Cancer Discovery 2022)。現在、この発見の契機となったMDSモデルマウスと、実際の患者さんの臨床検体を用いてMDSへの有効な治療介入法を研究しています。
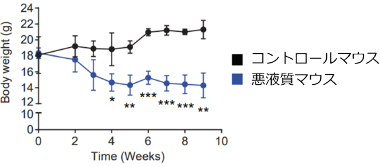
2. がん悪液質の分子病態の解明
がん悪液質とはがん患者に共通して生じる「やせ細る」症状のことです。骨格筋量の持続的な減少により進行性機能障害を生じる症候群で、がんの死因の2割を占めます。しかし、その病態は未だ明らかでなく根本的な治療薬もありません。私たちは樹立した悪液質モデルマウス(Blood Advances 2019)を使って、この病態解明に果敢に切り込むとともに、治療薬の探索を試みています。
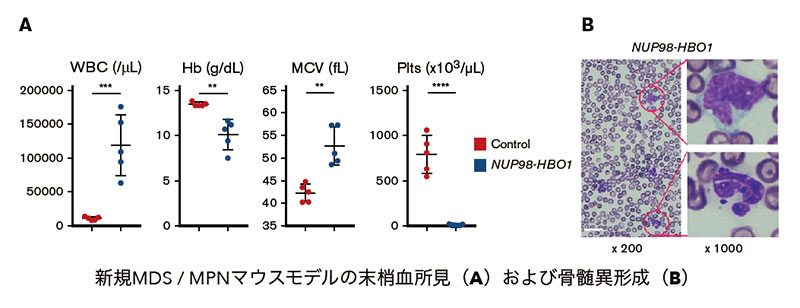
3. NUP98融合遺伝子による造血器腫瘍の分子病態の解明と治療薬開発
核膜孔複合体を構成するヌクレオポリンの一つであるNUP98遺伝子は染色体の転座により様々な遺伝子との融合遺伝子を形成し、その遺伝子産物が急性白血病(AML)やMDS、骨髄増殖生腫瘍(MPN)などの造血器腫瘍を引き起こします。これらNUP98融合遺伝子による造血器腫瘍は極めて難治性で確立した治療法がありません。我々は患者臨床検体を解析して新規のNUP98融合遺伝子を同定し、それを用いたMDS/MPN モデルマウスを樹立しました(Blood Advances 2019)。 発症機序に基づいて分子標的療法の候補分子を同定し、創薬を目指した研究を行っています。